Αιθυλενοδιαμινοτετραοξικό οξύ 99% 100g
Αιθυλενοδιαμινοτετραοξικό οξύ 99% 100g
EDTA (100gr)
C10H16N2O8
CAS No: 60-00-4
Το αιθυλενοδιαμινοτετραοξικό οξύ (αγγλ. Ethylene diamine tetraacetic acid – ακρωνύμιο EDTA), επίσης γνωστό ως εδετικό οξύ (edetic acid), ή απλά EDTA, είναι μια περίπλοκη χημική ένωση. Παρουσιάζει εξαιρετικά έντονη συμπλεκτική ικανότητα ως προς τα περισσότερα μεταλλοϊόντα. Ιστορικά, το EDTA παρασκευάστηκε για πρώτη φορά το 1935 από τον χημικό Ferdinand Munz, σε μια προσπάθεια παρασκευής ενός ισχυρού συμπλεκτικού αντιδραστηρίου των ιόντων ασβεστίου και άλλων μετάλλων, με σκοπό, ως συμπλεκτικό μέσο, να αντικαθιστούσε το τότε χρησιμοποιούμενο κιτρικό οξύ για την “αποσκλήρυνση” του πόσιμου νερού.
Αποτελεί την πιο διαδεδομένη και χρήσιμη χημική ένωση (chelating agent) με πολυάριθμες εφαρμογές, ιδίως στα τρόφιμα ως συντηρητικό και επίσης στην ιατρική. Είναι αμινοπολυκαρβοξυλικό οξύ με μοριακό τύπο [CH2N (CH2CO3H)₂]₂. Αυτό το λευκό, υδατοδιαλυτό στερεό χρησιμοποιείται ευρέως για τη σύνδεση με ιόντα σιδήρου (Fe) και ασβεστίου (Ca). Δεσμεύει αυτά τα ιόντα ως έναν παράγοντα χημικής σύμπλεξης. Λόγω της δομής του μορίου του, τα δύο άτομα αζώτου και τα τέσσερα άτομα οξυγόνου των οξικών ομάδων, είναι βασικά, διότι διαθέτουν αδεσμικά ηλεκτρόνια τα οποία μπορούν να διαθέσουν προς σχηματισμό ομοιοπολικών δεσμών με άλλα άτομα.
Φυσικοχημικές Ιδιότητες
Εμφάνιση: Λευκό κρυσταλλικό άοσμο στερεό.
Μοριακός τύπος: C10H16N2O8
Σχετική μοριακή μάζα: 292,25
Σημείο τήξης > 220ºC (υπό αποσύνθεση)
Πυκνότητα: 0,86 g/cm3
Μέτρια ισχυρό τετραπρωτικό οξύ (pK1 = 2,00, pK2 = 2,66, pK3 = 6,16, pK4 = 10,26
Διαλυτότητα στο Η2Ο: 0,50 g/L (~ 0,0017 M)
pH κορεσμ. διαλύματος: 2,0 – 2,5
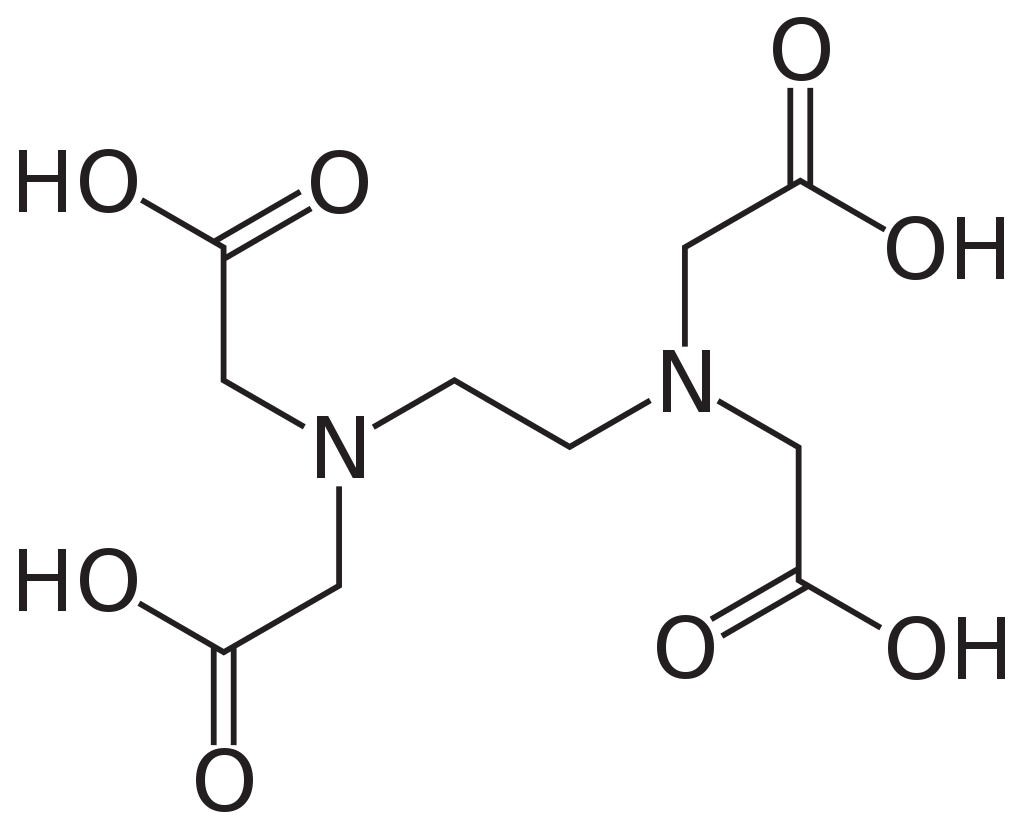
‘Χημική Δομή Αιθυλενοδιαμινοτετραοξικό οξύ 99%
Ασφάλεια και αποθήκευση
Προκαλεί ερεθισμό στα μάτια και στο δέρμα
Διατηρείται σε θερμοκρασία δωματίου
Τοξικολογικές έρευνες έδειξαν ότι το EDTA δρα ως κυτταροτοξική (cytotoxic) και ασθενώς γονοτοξική (mutagenic) ουσία σε πειραματόζωα, όχι όμως ως καρκινογόνο. Η λήψη EDTA από το στόμα έχει αποδειχθεί ότι προκαλεί αναπαραγωγικά και αναπτυξιακά προβλήματα, ως αποτέλεσμα της σύμπλεξης μετάλλων χρήσιμων για τον ανθρώπινο οργανισμό. Το πρώτο μέταλλο που συμπλέκεται είναι το ασβέστιο και κατά πάσα πιθανότητα ακολουθεί ο ψευδάργυρος. Για το δινάτριο άλας του EDTA (Na2H2EDTA) αναφέρονται τιμές LD50 2000-2300 mg/kg για αρουραίους και κουνέλια (λήψη από το στόμα) . Η μέγιστη αποδεκτή ημερήσια λήψη του συμπλόκου Na2CaEDTA έχει καθοριστεί στα 2,5 mg/kg (FAO/WHO 1974) και του συμπλόκου NaFe(III)EDTA στα 0,8 mg/kg (FAO/WHO 2000)
Γενικά το EDTA και τα άλατά του δεν θεωρούνται ως επικίνδυνες τοξικές ουσίες και δεν απαιτούν ιδιαίτερες προφυλάξεις κατά την κανονική χρήση τους. Τα προβλήματα τοξικότητας μπορεί να προκύψουν μόνο μετά από μακροχρόνιες εκθέσεις σε μεγάλες ποσότητες στο εργασιακό περιβάλλον, όπως π.χ. στις βιομηχανίες παρασκευής EDTA. Αντίθετα το EDTA έχει πολλές φαρμακευτικές εφαρμογές, προστίθεται στα καλλυντικά, όπως και στα τρόφιμα (ως NaFe(III)EDTA), επειδή αυξάνει τη βιοδιαθεσιμότητα του σιδήρου, ειδικά για άτομα με αναιμία ή έλλειψη σιδήρου. To NaFe(III)EDTA έχει προταθεί για ενίσχυση (fortification) του άρτου και των δημητριακών που καταναλώνονται ως πρωϊνή τροφή (cereals). Η χρήση EDTA σε καλλυντικά σε χαμηλές συγκεντρώσεις έχει αποδειχθεί ασφαλής.
Αναλυτική περιγραφή Αιθυλενοδιαμινοτετραοξικό οξύ 99%
Ιστορία
Το αιθυλενοδιαμινοτετραοξικό οξύ (εδετικό οξύ, edetic acid ή απλά EDTA) είναι ο γνωστότερος και πλέον τυπικός εκπρόσωπος μιας σειράς ενώσεων, οι οποίες γενικά ονομάζονται αμινοπολυκαρβοξυλικά οξέα και χαρακτηρίζονται από μια εξαιρετικά έντονη συμπλεκτική ικανότητα ως προς τα περισσότερα μεταλλοϊόντα.
Το EDTA παρασκευάστηκε για πρώτη φορά το 1935 από τον χημικό Ferdinand Munz της Γερμανικού βιομηχανικού συγκροτήματος I. G. Farbenindustrie, σε μια προσπάθεια παρασκευής ενός ισχυρού συμπλεκτικού αντιδραστηρίου των ιόντων ασβεστίου και άλλων μετάλλων. ‘Ενα συνθετικό ισχυρό συμπλεκτικό μέσο θα αντικαθιστούσε το ευρύτατα χρησιμοποιούμενο κιτρικό οξύ για την “αποσκλήρυνση” του ύδατος. Η Γερμανία πραγματοποιούσε μέχρι τότε εισαγωγές μεγάλων ποσοτήτων κιτρικού οξέος που θα ήταν αδύνατον να συνεχισθούν κατά τον επικείμενο πόλεμο.
Χημικές ιδιότητες του EDTA
Το EDTA ως οξύ: Το EDTA συμπεριφέρεται ως τετραπρωτικό οξύ. Είναι ένα μέτρια ισχυρό οξύ (τουλάχιστον ως προς τα δύο πρώτα στάδια διάστασής του) και συνήθως παριστάνεται ως Η4EDTA και τα διάφορα άλατά του ως π.χ. Νa2H2EDTA, Na4EDTA, Na2CaEDTA. Επίσης συνηθίζεται ο απλούστερος συμβολισμός του ως Η4Υ. Οι ισορροπίες διάστασης του EDTA και οι αντίστοιχες σταθερές διάστασης παρουσιάζονται παραπλεύρως.
Διιόντα EDTA: ‘Οταν το EDTA διαλύεται στο νερό συμπεριφέρεται όπως τα αμινοξέα σχηματίζοντας διιόντα (zwitterions), δηλαδή ουδέτερα σωματίδια με θέσεις αντίθετου ηλεκτρικού φορτίου. Πρωτόνια αποσπώνται από τις καρβοξυλικές ομάδες και δεσμεύονται από τις αμινοομάδες. Οι πρώτες φορτίζονται αρνητικά και οι δεύτερες θετικά. Αυτό συμβαίνει και στα δύο άκρα του μορίου που αποτελεί έτσι ένα “διπλό διιόν“. ‘Ετσι, στο μόριο του EDTA (H4Y) υπάρχουν τέσσερις φορτισμένες θέσεις, δύο με θετικό και δύο με αρνητικό φορτίο και επομένως το συνολικό φορτίο του παραμένει μηδενικό.
Εφαρμογές του EDTA
Χαρτοβιομηχανία:
Οι μεγαλύτερες ποσότητες του EDTA χρησιμοποιούνται στις βιομηχανίες χαρτοπολτού και χάρτου. Το EDTA (μαζί με το DTPA) δεσμεύει μικροποσότητες μεταλλοϊόντων, τα οποία αν παραμείνουν στον χαρτοπολτό δυσχεραίνουν τη διαδικασία λεύκανσής του με H2O2, προκαλώντας την καταλυτική του διάσπαση. Σημειώνεται ότι ο αποχρωματισμός του χαρτοπολτού με Η2Ο2 αντικαθιστά την παλαιότερη μέθοδο αποχρωματισμού με χλώριο, όπου τα μεταλλοϊόντα δεν αποτελούσαν πρόβλημα
Απορρυπαντικά:
Μεγάλες ποσότητες EDTA χρησιμοποιούνται στην παραγωγή απορρυπαντικών βιομηχανικής, οικιακής και νοσοκομειακής χρήσης, όπως και στα καθαριστικά αυτοκινήτων. Ο ρόλος του EDTA είναι πολλαπλός: δεσμεύει τα ιόντα Ca2+ και Mg2+ από τα “σκληρά” φυσικά ύδατα, τα οποία αντιδρώντας με τα ανιοντικά απορρυπαντικά θα εξουδετέρωναν την απορρυπαντική τους δράση, επιπλέον σταθεροποιεί τα υπερβορικά άλατα (λευκαντικοί παράγοντες) δεσμεύοντας μεταλλικά ιχνοστοιχεία που θα κατέλυαν τη διάσπασή τους. Ακόμη αποτρέπει το σχηματισμό ασβεστούχων αποθέσεων (scales), που θα καταστρέφανε μηχανικά συστήματα (πλυντήρια) ή θα απέφρασαν σωληνώσεις και θα αχρήστευαν εναλλάκτες θερμότητας σε βιομηχανικές εγκαταστάσεις.
Τρόφιμα – Φάρμακα – Γεωργικά προϊόντα:
Το EDTA έχει εγκριθεί από την Υπηρεσία Τροφίμων και Φαρμάκων των ΗΠΑ (Food and Drug Administration, FDA) ως συντηρητικό σε πακεταρισμένα τρόφιμα, σε βιταμίνες και σε παιδικές τροφές. Προστίθεται ως σταθεροποιητής, για να προλάβει την αλλοίωσή τους λόγω οξειδωτικών αλλοιώσεων που καταλύονται από ελεύθερα μεταλλικά ιόντα. ‘Ετσι το πρόσθετο (Ε-ουσία) Ε385 είναι το άλας Na2CaEDTA και το Ε386 είναι το Na2H2EDTA. Τυπικά αυτές οι Ε-ουσίες χαρακτηρίζονται ως “συμπλεκτικά μέσα” (sequestrants, to sequester: αποσπώ, διαχωρίζω).
Διάφορες βιομηχανικές εφαρμογές.
Ενδιαφέρον παρουσιάζει το σύστημα Fe(II)-EDTA/Fe(III)-EDTA. Το σύμπλοκο Fe(III)-EDTA δρα ως “αναγεννώμενο” και “περιβαλλοντικά φιλικό” ήπιο οξειδωτικό μέσο. Ουσιαστικά δρα ως καταλύτης οξείδωσης πολλών χημικών ρύπων από το ατμοσφαιρικό οξυγόνο. ‘Ετσι, π.χ. χρησιμοποιείται για την απαλλαγή βιομηχανικών απαερίων από το υδρόθειο αναγόμενο προς Fe(II)-EDTA, το οποίο εύκολα επανοξειδώνεται προς Fe(III)-EDTA από το οξυγόνο του αέρα, σύμφωνα με τον παραπλεύρως κύκλο. Η διαδικασία πραγματοποιείται σε ουδέτερο έως ελαφρά αλκαλικό περιβάλλον. Το σύστημα απλών αλάτων Fe(III)/Fe(II) δεν θα παρείχε ικανοποιητικά αποτελέσματα, λόγω καθίζησης του σιδήρου ως Fe(OH)3 και FeS. Το σύμπλοκο Fe(III)-EDTA χρησιμοποιείται για την οξειδωτική διαλυτοποίηση των κόκκων αργύρου από τα φωτογραφικά φιλμ. Ανάλογο σύστημα χρησιμοποιείται σε βιοκαθαρισμούς και για την απομάκρυνση των οξειδίων αζώτου (ΝΟx) κατά τον καθαρισμό απαερίων (καυσαερίων, flue gases)
Το EDTA στην ιατρική:
To EDTA έχει χρησιμοποιηθεί με επιτυχία σε περιπτώσεις δηλητηριάσεων από βαρέα μέταλλα. Ενώ τα ελεύθερα ιόντα των βαρέων μετάλλων έχουν καταστρεπτικές ιδιότητες συνδεόμενα με πρωτεΐνες, αναστέλλοντας τη λειτουργία τους ή καταστρέφοντάς τις, έχει διαπιστωθεί ότι χάρις στην εξαιρετική σταθερότητά τους, τα σύμπλοκά τους με το EDTA έχουν περιορισμένη έως και μηδενική τοξικότητα και μπορούν να απομακρυνθούν από το αίμα μέσω των νεφρών.
Περιβαλλοντική ρύπανση και συμπεριφορά του EDTA στο περιβάλλον
Η μεγάλη χρήση του EDTA σε διάφορες εφαρμογές και η αργή απομάκρυνσή του κάτω από ορισμένες περιβαλλοντικές συνθήκες έχει δημιουργήσει προβλήματα ρύπανσης του περιβάλλοντος και ιδιαίτερα των επιφανειακών νερών στις Ευρωπαϊκές χώρες. Σε ποταμούς της Ευρώπης έχουν μετρηθεί συγκεντρώσεις EDTA της τάξης των 10-100 μg/L, ενώ σε λίμνες 1-10 μg/L. Στις ΗΠΑ, σε υπόγεια νερά που δέχονται υγρά απόβλητα έχουν αναφερθεί συγκεντρώσεις EDTA 1-72 μg/L.
Το EDTA δεν διασπάται σε συνήθεις συνθήκες και δεν απομακρύνεται κατά την τυπική κατεργασία υγρών αποβλήτων. Ωστόσο, με κατάλληλη ρύθμιση του pH των αποβλήτων και της λάσπης και του χρόνου παραμονής τους, το EDTA μετατρέπεται σχεδόν εξ ολοκλήρου σε ανόργανες ουσίες (mineralization). Φαίνεται ότι διασπάται από κάποιους μικροοργανισμούς που βρίσκονται στα απόβλητα, το έδαφος και τη λυματολάσπη.


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones


