Υδροξείδιο του Νατρίου 5kg , pellets
Το υδροξείδιο του νατρίου ή καυστικό νάτριο ή καυστική σόδα είναι ετεροπολική (ιοντική) ένωση, ισχυρή βάση με χημικό τύπο NaOH.Είναι ουσία λευκή, κρυσταλλική, πολύ υγροσκοπική, και απορροφά διοξείδιο του άνθρακα από την ατμόσφαιρα, για αυτό πρέπει να αποθηκεύεται σε δοχεία καλά κλεισμένα και αεροστεγή. Το καθαρό υδροξείδιο του νατρίου διατίθεται στο εμπόριο σε πλαστικά δοχεία σε κοκκώδη μορφή. Είναι χημική ένωση πολύ διαλυτή στο νερό και η διάλυση αυτή είναι ισχυρά εξώθερμη. Είναι επίσης διαλυτή στην αιθανόλη (οινόπνευμα) και στη μεθανόλη.
Παραγωγή
Eργαστηριακές μέθοδοι
1. Επίδραση νερού στο νάτριο[1] :
{displaystyle Na+H_{2}O{xrightarrow {}}NaOH+{frac {1}{2}}H_{2}uparrow }
2. Επίδραση νερού στο οξείδιο του νατρίου:
{displaystyle Na_{2}O+H_{2}O{xrightarrow {}}2NaOH}
3. Αντίδραση διπλής αντικαταστάσεως, δηλαδή του τύπου «άλας1 + βάση1 ? άλας2 + βάση2». Το παραγόμενο «άλας2» πρέπει να είναι δυσδιάλυτο, έτσι ώστε να καθιζάνει στο δοχείο και να απομακρύνεται μετά με διήθηση. Η «βάση2» μπορεί να απομονωθεί μετά από εξάτμιση του νερού του διαλύματος. Π.χ.:
{displaystyle Na_{2}SO_{4}+Ba(OH)_{2}{xrightarrow {}}2NaOH+BaSO_{4}downarrow }
Βιομηχανικές μέθοδοι[Επεξεργασία | επεξεργασία κώδικα]
1. «Καυστικοποίηση» του ανθρακικού νατρίου (σόδας), που γίνεται με επίδραση ασβεστόνερου:
{displaystyle Na_{2}CO_{3}+Ca(OH)_{2}{xrightarrow {}}2NaOH+CaCO_{3}downarrow }
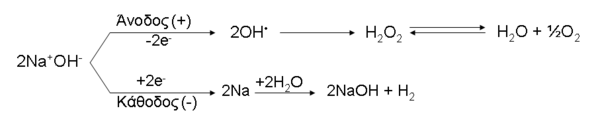
2. Ηλεκτρόλυση πυκνού διαλύματος χλωριούχου νατρίου (NaCl) με αδρανή ηλεκτρόδια. Αποτελεί τη σημαντικότερη μέθοδο παραγωγής NaOH σε βιομηχανική κλίμακα και πραγματοποιείται γενικά ως εξής:
* Η συνολκή αντίδραση είναι:
{displaystyle NaCl+H_{2}O{xrightarrow {eta lambda epsilon kappa tau rho {acute {o}}lambda upsilon sigma eta }}NaOH+{frac {1}{2}}Cl_{2}uparrow +{frac {1}{2}}H_{2}uparrow }
Χημικές ιδιότητες – αντιδράσεις
Τόσο το υδατικό διάλυμα, όσο και το τήγμα NaOH είναι ισχυρές βάσεις σύμφωνα με τη θεωρία για τις βάσεις του Αρρένιους. Το ανιόν υδροξύλιο (OH?) είναι η ισχυρότερη βάση σύμφωνα με τη θεωρία οξέων-βάσεων των Br?nsted–Lowry. Το OH? είναι επίσης βάση κατά Lewis.
Το NaΟΗ είναι πολύ σταθερή ένωση και δεν διασπάται με θέρμανση. Μπορεί να κρυσταλλωθεί με διαφορετικό πλήθος μορίων νερού σε διάφορες θερμοκρασίες :
- NaOH·H2O όταν η θερμοκρασία είναι μεταξύ -28 °C και -24 °C.
- NaOH·7H2O όταν η θερμοκρασία είναι μεταξύ -24 °C και -17,7 °C.
- NaOH·5H2O όταν η θερμοκρασία είναι μεταξύ -17,7 °C και -5,4 °C.
- NaOH·4H2O όταν η θερμοκρασία είναι μεταξύ -5,4 °C και 12,3 °C.
- NaOH·H2O όταν η θερμοκρασία είναι μεταξύ -5,4 °C και 12,3 °C.
Από τα υδατικά διαλύματά του, το NaOH κρυσταλλώνεται ως μονοϋδρίτης μεταξύ 12,8 °C και 61,8 °C με σημείο τήξεως 65,1 °C και πυκνότητα 1,829 kg/m3. Δίνει τις εξής αντιδράσεις :
1. Αντιδράσεις οξέος-βάσης. Αυτές είναι των γενικών σχημάτων «βάση + οξύ ? άλας + νερό» και «βάση + όξινο οξείδιο ? άλας + νερό». π.χ.:
{displaystyle NaOH+HNO_{3}{xrightarrow {}}NaNO_{3}+H_{2}O}
{displaystyle 2NaOH+SO_{3}{xrightarrow {}}Na_{2}SO_{4}+H_{2}O}
{displaystyle NaOH+CO_{2}{xrightarrow {}}Na_{2}CO_{3}+H_{2}O}
{displaystyle NaOH+HCl{xrightarrow {}}NaCl+H_{2}O}
2. Αντιδράσεις καταβύθισης ιζήματος ή έκλυσης αερίου με το γενικό σχήμα «βάση + άλας ? νέα βάση + νέο άλας» π.χ.
{displaystyle ZnSO_{4}+2NaOH{xrightarrow {}}Na_{2}SO_{4}+Zn(OH)_{2}downarrow }
{displaystyle NaOH+NH_{4}Cl{xrightarrow {}}NaCl+H_{2}O+NH_{3}uparrow }
3. Αντιδρά με θέρμανση με το αργίλιο (Al), τον ψευδάργυρο (Zn) και τον κασσίτερο (Sn), ενώ με σύντηξη αντιδρά και με το βόριο (Β) και το πυρίτιο (Si) :
{displaystyle Al+3NaOH{xrightarrow {}}Na_{3}AlO_{2}+{frac {3}{2}}H_{2}uparrow }
{displaystyle Zn+2NaOH{xrightarrow {}}Na_{2}ZnO_{2}+H_{2}uparrow }
{displaystyle Sn+2NaOH+H_{2}O{xrightarrow {}}Na_{2}SnO_{3}+2H_{2}uparrow }
{displaystyle B+3NaOH{xrightarrow {}}Na_{3}BO_{3}+{frac {3}{2}}H_{2}uparrow }
{displaystyle Si+2NaOH{xrightarrow {}}Na_{2}SiO_{3}+2H_{2}uparrow }
4. Προσβάλλει το γυαλί αντιδρώντας με το οξείδιο του πυριτίου (SiO2) που αυτό περιέχει:
{displaystyle SiO_{2}+NaOH{xrightarrow {}}Na_{2}SiO_{3}+2H_{2}Ouparrow }
Γι’ αυτό δεν πρέπει να αποθηκεύεται πυκνό διάλυμα NaOH μέσα σε γυάλινο σκεύος για πολύ καιρό. Δεν προσβάλλει τον σίδηρο.
5. Αντιδρά με οργανικές ενώσεις που παρουσιάζουν όξινες ιδιότητες, όπως είναι τα καρβοξυλικά οξέα (RCOOH)[3] και οι φαινόλες[4]. Π.χ.:
{displaystyle RCOOH+NaOH{xrightarrow {}}RCOONa+H_{2}O}
{displaystyle PhOH+NaOH{xrightarrow {}}PhONa+H_{2}O}
6. Επίσης αντιδρά με τα αλκυλαλογονίδια (CνH2ν+1X) και με τα υπόλοιπα οργανικά αλογονίδια [5]:
- α. Aραιά διαλύματα NaOH υποκαθιστούν το αλογόνο με υδροξύλιο. Π.χ.:
{displaystyle RX+NaOH{xrightarrow {}}ROH+NaX}
- Η αντίδραση γίνεται ευκολότερα με το Χ = Ι.
- β. Πυκνά διαλύματα NaOH ή καλύτερα διαλύματα NaOH σε αλκοόλες (ROH) δείνουν α-απόσπαση υδραλογόνου. Π.χ.:
{displaystyle RCH_{2}CH_{2}X+NaOH{xrightarrow {ROH}}RCH=CH_{2}+NaX+H_{2}O}
- γ. Πυκνά διαλύματα NaOH σε αλογονίδια που δεν περιέχουν υδρογόνο σε διπλανό άτομο άνθρακα δείνουν καρβένια, αν και για το σκοπό αυτό προτιμάται το KOH. Επίσης από τα αλογόνα προτιμάται το χλώριο. Π.χ.:
{displaystyle CHCl_{3}+NaOH{xrightarrow {}}[:CCl_{2}]+NaCl+H_{2}O}
- Τα παραγόμενα καρβένια είναι ασταθέστατες ενώσεις του CII και πρακτικά λειτουργούν ως πολύ δραστικές δίριζες: Δίνουν αντιδράσεις παρεμβολής στους απλούς δεσμούς και αντιδράσεις προσθήκης στους πολλαπλούς. Προκύπτουν όλα τα πιθανά παράγωγα σε σχεδόν απόλυτα κινητικές αναλογίες. Π.χ.:
{displaystyle [:CCl_{2}]+CH_{3}CH=CH_{2}{xrightarrow {}}{frac {3}{8}}Cl_{2}CHCH_{2}CH=CH_{2}+{frac {2}{8}}CH_{3}CH=CHCHCl_{2}+{frac {1}{8}}Cl_{2}CHC(CH_{3})=CH_{2}+{frac {1}{8}}CH_{3}CH(Cl)_{2}CH=CH_{2}+}
{displaystyle +{frac {1}{8}}}
7. Ενδιαφέρον παρουσιάζει η αντίδραση του NaOH με τους κορεσμένους εστέρες του τύπου RCOOR’[6], οπότε παράγονται άλατα με Na και αλκοόλες. Η αντίδραση είναι βασική υδρόλυση πιό γνωστή ως σαπωνοποίηση αφού αποτελεί την κυριότερη μέθοδο παραγωγής σαπουνιού:
{displaystyle RCOOR{acute {}}+NaOH{xrightarrow {}}RCOONa+R{acute {}}OH}
8. Το αραιό διάλυμα NaOH αντιδρά με το χλώριο (Cl2) και το βρώμιο (Br2). Π.χ.:
{displaystyle Cl_{2}+alpha rho .NaOH{xrightarrow {}}NaClO+NaCl}
Η αντίδραση είναι μια αυτοοξειδοαναγωγή, διότι ένα μέρος του αλογόνου οξειδώνεται [8] και ένα μέρος ανάγεται[9].
9. Το πυκνό διάλυμα NaOH αντιδρά με το Cl2, το Br2 και το ιώδιο (Ι2) με ταυτόχρονη θέρμανση π.χ.:
{displaystyle 3I_{2}+6NaOH{xrightarrow {triangle }}5NaI+NaIO_{3}+3H_{2}O}
Κι αυτή η αντίδραση είναι μια αυτοοξειδοαναγωγή [10].
10. Το πυκνό διάλυμα NaOH αυτοοξειδώνει[11] επίσης τον φωσφόρο P4. Έτσι παράγεται φωσφίνη (PH3) και υποφωσφορώδες νάτριο (NaH2PO2):
{displaystyle P_{4}+3NaOH+3H_{2}O{xrightarrow {}}PH_{3}+3NaH_{2}PO_{2}}
11. Ηλεκτρόλυση διαλύματος NaOH με αδρανή ηλεκτρόδια. Μέσα στο διάλυμα του ηλεκτρολύτη υπάρχουν: Na+, OH–, Η+, H2O:
- Η συνολκή αντίδραση είναι:
{displaystyle H_{2}O{xrightarrow {eta lambda epsilon kappa tau rho {acute {o}}lambda upsilon sigma eta }}H_{2}uparrow +{frac {1}{2}}O_{2}uparrow }
12. Ηλεκτρόλυση τήγματος NaOH με αδρανή ηλεκτρόδια. Στο τήγμα υπάρχουν μόνο τα ιόντα Na+ και ΟΗ? από το κρυσταλλικό πλέγμα του NaOH.
- Η συνολκή αντίδραση είναι:
{displaystyle NaOH{xrightarrow[{triangle }]{eta lambda epsilon kappa tau rho {acute {o}}lambda upsilon sigma eta }}Na+H_{2}Ouparrow +{frac {1}{2}}O_{2}uparrow }
Χρήσεις
Το υδροξείδιο του νατρίου χρησιμοποιείται :
- Ως ρυθμιστής οξύτητας στα τρόφιμα και για την ενίσχυση της βιομηχανικής αποφλοίωσης φρούτων, για την ενίσχυση του χρώματος των ελαιών και για την παρασκευή της καραμέλας.
- Στην παραδοσιακή παρασκευή σαπουνιών με τη διαδικασία της σαπωνοποίησης.
- Στη βιομηχανία τεχνητού μεταξιού.
- Στην κατεργασία του βαμβακιού.
- Στον καθαρισμό των


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones