Σιδηρικυανιούχο Κάλιο 99% 1kg
Σιδηρικυανιούχο Κάλιο 99% 1kg
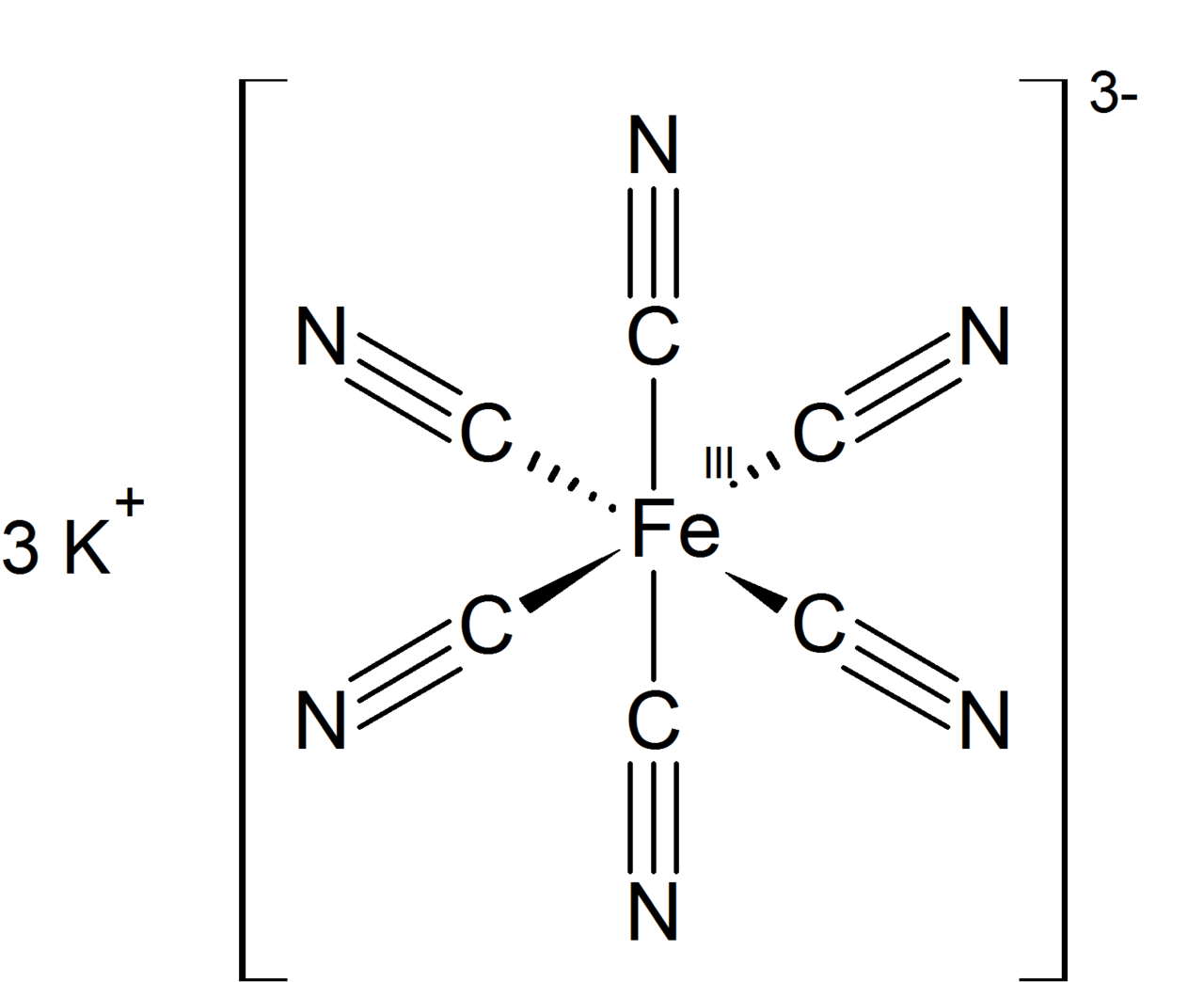
Το σιδηρικυανιούχο κάλιο είναι η γνωστότερη ένωση συναρμογής (σύμπλοκο) του σιδήρου(ΙΙΙ) και έχει τύπο K3[Fe(CN)6]. Λέγεται και πρωσικό κόκκινο της ποτάσας. Σε θερμοκρασία δωματίου, κρυσταλλώνεται σχηματίζοντας βαθυκόκκινους κρυστάλλους. Διαλύεται στο νερό και το διάλυμα αποκτά ελαφριά κιτρινοπράσινη απόχρωση. Διαλύεται επίσης στο οινόπνευμα και στα οξέα. Η ένωση αποσυντίθεται σε θερμοκρασία μεγαλύτερη των 200 °C.
Φυσικοχημικές Ιδιότητες
Μοριακός τύπος: K3[Fe(CN)6]
Μοριακό βάρος: 329,244 g/mol
Σημείο ζέσης: Αποσυντίθεται
Πυκνότητα: 1,89 g/mL
Διαλυτότητα στο νερό: 29,9 g/100 mL (0 °C)
38,3 g/100 mL (10 °C)
46 g/100 mL (20 °C)
48,8 g/100 mL (25 °C)
52,7 g/100 mL (30 °C)
59,5 g/100 mL (40 °C)
70,9 g/100 mL (60 °C)
81,8 g/100 mL (80 °C)
91,6 g/100 mL (100 °C)
Εμφάνιση: κόκκινο, κρυσταλλικό στερεό
Χημική Δομή Σιδηρικυανιούχο Κάλιο 99% 1kg
Ασφάλεια και αποθήκευση


Επικίνδυνο για την υγεία Επικίνδυνο για το περιβάλλον Προκαλεί ερεθισμό στα μάτια και στο δέρμα
Διατηρείται σε θερμοκρασία δωματίου.
Αναλυτική περιγραφή
Το σιδηρικυανιούχο κάλιο είναι σκούρο κόκκινο κρυσταλλικό στερεό. Στη θερμοκρασία βρασμού του αποσυντίθεται. Είναι διαλυτό στο οινόπνευμα και στο νερό και η διαλυτότητά του αυξάνεται (σχεδόν διπλασιάζεται) όταν το νερό είναι ζεστό. Δεν αναφλέγεται.
Κρυσταλλώνεται στο ορθορομβικό σύστημα με παραμέτρους κυψελίδας α = 1345 pm , b = 1043 pm , c = 840 pm, παρόλο που είναι γνωστή και η μονοκλινής μορφή.
Το στερεό K3[Fe(CN)6] παρουσιάζει μια ισχυρή μονή ταινία στο υπέρυθρο φάσμα του δεσμού C≡N στα 2125 cm−1. Σε υδατικό διάλυμα η ταινία είναι στα 2118 cm−1 και η συχνότητα τάσης του δεσμού Fe-C στα 389 cm−1. Το φάσμα απορρόφησης σε υδατικό διάλυμα εκτιμήθηκε στα 35000 cm−1
Χρήσεις
Κατά το 19ο αιώνα, το σύμπλοκο χρησιμοποιήθηκε για την εμφάνιση και ανάδειξη των ξεθωριασμένων μελανιών κατά την ανάγνωση παλίμψηστων και παλιών χειρογράφων[13].
Η ένωση έχει ευρεία χρήση στην κατασκευή έγχρωμων σχεδίων σε μεμβράνες και στις κυανοτυπίες. O Χέρσελ (Sir John Herschel, 1792-1871) ανακάλυψε την κυανοτυπία ή μπλε εκτύπωση το 1842, συνδυάζοντας άλατα σιδήρου με κιτρικό αμμώνιο και σιδηρικυανιούχο κάλιο και παρήγαγε μπλε χρώμα υπό την επίδραση του φωτός. Ήταν μια απλή διαδικασία που απαιτούσε μόνο νερό ως σταθεροποιητικό.
Το σιδηρικυανιούχο κάλιο χρησιμοποιείται επίσης ως οξειδωτικός παράγοντας για την απομάκρυνση του αργύρου από τα αρνητικά και θετικά, διαδικασία που ονομάζεται χαρακτική κουκίδας.
Στις έγχρωμες φωτογραφίες, το σιδηρικυανιούχο κάλιο χρησιμοποιείται για να μειώσει το μέγεθος του χρώματος των κουκκίδων χωρίς ταυτόχρονη μείωση του αριθμού τους. Επίσης χρησιμοποιείται στη φωτογραφική τέχνη σε μίγμα μαζί με θειοθειικό νάτριο για να μειώσει την πυκνότητα του αρνητικού. Το μίγμα αυτό, που είναι γνωστό ως αναγωγικό Farmer, μπορεί να συμβάλλει στην αντιστάθμιση των προβλημάτων υπερέκθεσης.
Το σιδηρικυανιούχο κάλιο είναι το ένα από τα δύο συστατικά, το άλλο είναι η φαινολοφθαλεΐνη, που δημιουργούν διάλυμα συμπλοκομετρικού δείκτη ο οποίος αποκτά μπλε χρώμα με την παρουσία ιόντων Fe2+ και ο οποίος μερικές φορές χρησιμοποιείται στην ανίχνευση οξείδωσης μετάλλου που οδηγεί σε σκουριά.
Χημικές Χρήσεις
Το σιδηρικυανιούχο κάλιο, σε συνδυασμό με το OsO4, έχει χρησιμοποιηθεί για την καλλιέργεια κυττάρων για παρατήρηση με το σαρωτικό ηλεκτρονικό µικροσκόπιο. Σ’ αυτές τις περιπτώσεις η κατεργασία των δειγμάτων γίνεται με διάλυμα γλουταραλδεΰδης-χλωριούχου ασβεστίου σε ουδέτρο pH για 90 λεπτά στους 4 °C και στη συνέχεια η κατεργασία ολοκληρώνεται με διάλυμα 1 % σε OsO4 και 0,8 % K3[Fe(CN)6] για 1 – 2 ώρες σε θερμοκρασία δωματίου.
Είναι πρόδρομη ένωση για την παρασκευή κόκκινου σιδηρικυανιούχου αργύρου, Ag3[Fe(CN)6] , καστανοπράσινου σιδηρικυανιούχου χαλκού, Cu3[Fe(CN)6]2 και καστανού ένυδρου σιδηρικυανιούχου μολύβδου, Pb3[Fe(CN)6]2·6H2O.
Το σιδηρικυανιούχο κάλιο μπορεί να χρησιμοποιηθεί ως πηγή αναπλήρωσης του αζώτου για τα φυτά. Σε σχετικά πειράματα, τα φυτά είτε στερούνταν το άζωτο είτε μεταφέρονταν σε περιβάλλον πλούσιο σε άζωτο εξαιτίας της ύπαρξης σιδηρικυανιούχου καλίου ή παραγώγων του όπως το σιδηροκυανιούχο κάλιο. Τα φυτά ήταν σε θέση να αυτοσυντηρηθούν αποκλειστικά με τα κυανιούχα, ενώ αξιοποιούσαν τις κυανιούχες ενώσεις σε περίπτωση απουσίας αζώτου. Επιπλέον, τα φυτά φάνηκαν ότι είχαν και διαφορετικές μεθόδους για την απορρόφηση των δύο συμπλόκων.
Άλλες χρήσεις του σιδηρικυανιούχου καλίου είναι στο “βάψιμο” του ατσαλιού, στη χαρακτική, σε ηλεκτροαποθέσεις, ως χρωστική του βαμβακιού κ.ά.


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones


