Διχλωριούχος Κασσίτερος 100g
Διχλωριούχος Κασσίτερος 100g
ένυδρος
Οι ενώσεις κασσίτερου (ΙΙ) ονομάζονταν παλιότερα κασσιτερώδεις ενώσεις και οι ενώσεις κασσίτερου (IV) ονομάζονταν κασσιτερικές. Για παράδειγμα, ο διχλωριούχος κασσίτερος (SnCl2) μπορεί να αναφέρεται ως «κασσιτερώδες χλώριδιο». Τα άλατα Sn(II) είναι αρκετά ισχυρά αναγωγικά μέσα και έχουν ετεροπολικό χαρακτήρα.
O χλωριούχος κασσίτερος προστίθεται επίσης ως πρόσθετο τροφίμων με αριθμό Ε Ε512 σε μερικά κονσερβοποιημένα και εμφιαλωμένα τρόφιμα, όπου χρησιμεύει ως παράγοντας κατακράτησης χρώματος και αντιοξειδωτικό.Το SnCl2 χρησιμοποιείται στην αγγειογραφία ραδιονουκλεϊδίων για τη μείωση του ραδιενεργού παράγοντα τεχνήτιου-99m-υπερτεχνητικό για να βοηθήσει στη σύνδεση με τα κύτταρα του αίματος. Το υδατικό διάλυμα χλωριούχου κασσίτερου χρησιμοποιείται από πολλούς χομπίστες και επαγγελματίες, που εξαγνίζουν πολύτιμα μέταλλα ως δείκτη των μετάλλων χρυσού και ομάδας πλατίνας σε διαλύματα.Το τετηγμένο SnCl2 μπορεί να οξειδωθεί για να σχηματίσει πολύ κρυσταλλικές SnO2 νανοδομές.
Φυσικοχημικές Ιδιότητες για Διχλωριούχος Κασσίτερος
Μοριακός Τύπος: SnCl2 x2H2O
Μοριακή μάζα: 189.60 g/mol (anhydrous) 225.63 g/mol (dihydrate)
Εμφάνιση: λευκό κρυσταλλικό στερεό
Οσμή: άοσμο
Πυκνότητα:3.95 g/cm3 (anhydrous) 2.71 g/cm3 (dihydrate)
Σημείο τήξης: 247 °C (477 °F; 520 K) (anhydrous)
37.7 °C (dihydrate)
Σημείο Ζέσης: 623 °C (1,153 °F; 896 K) (decomposes)
Διαλυτότητα στο νερό: 83.9 g/100 ml (0 °C)
Υδρολύεται σε χεστό νερό
Διαλυτότητα: Διαλυτό σε αιθανόλη, ακετόνη, αιθέρα, τετραυδροφουράνιο
Αδιάλυτο σε ξυλένιο
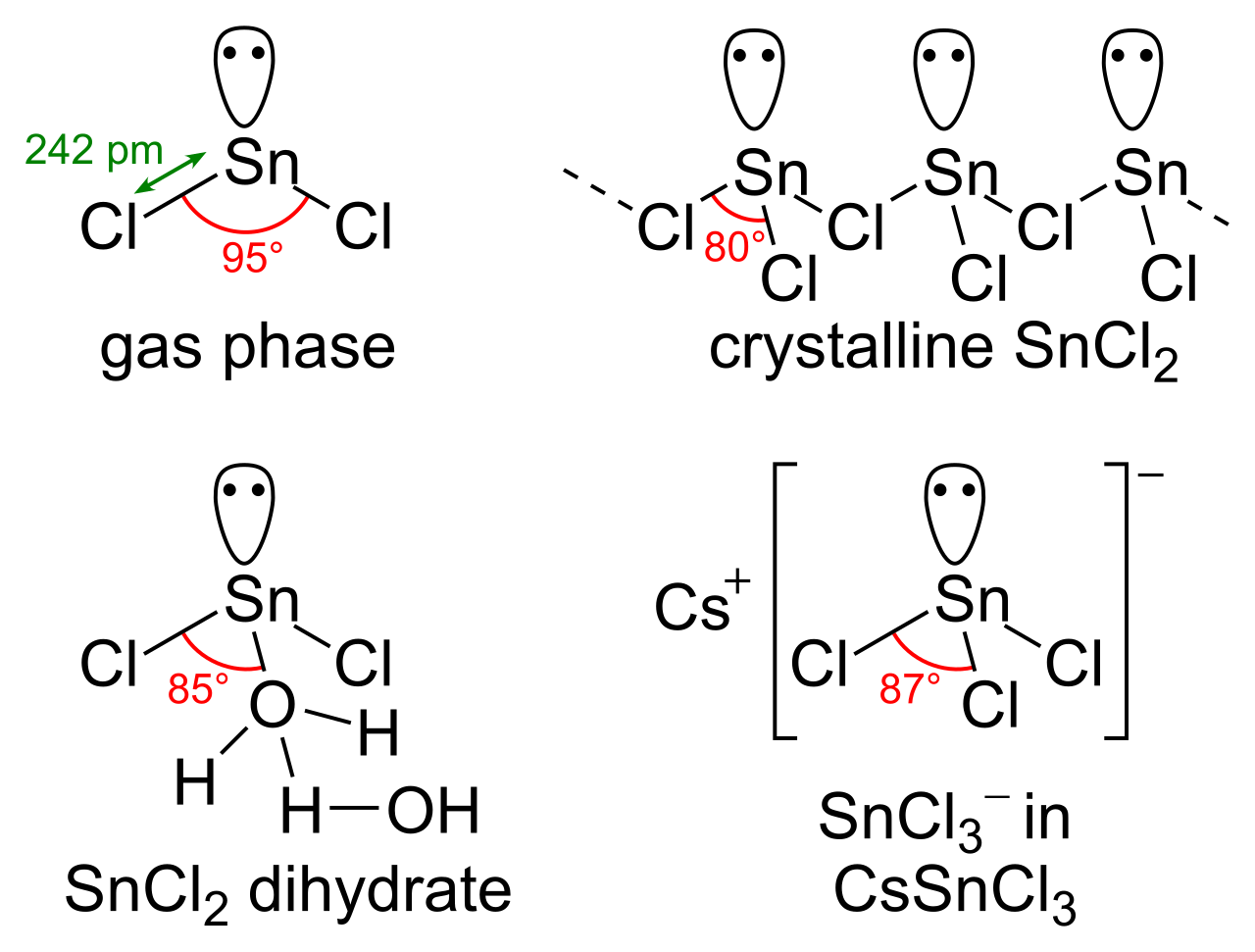
Χημική Δομή
Ασφάλεια και αποθήκευση



Διαβρωτικό Προκαλεί ερεθισμό Επικίνδυνο για Επικίνδυνο για το
στα μάτια και στο την υγεία περιβάλλον
δέρμα
Διτηρείται σε θερμοκρασία περιβάλλοντος
Αναλυτική περιγραφή για Διχλωριούχος Κασσίτερος
Το SnCl2 έχει ένα μόνο ζεύγος ηλεκτρονίων, έτσι ώστε το μόριο στην αέρια φάση να κάμπτεται. Στην στερεά κατάσταση, το κρυσταλλικό SnCl2 σχηματίζει αλυσίδες συνδεδεμένες μέσω χλωριούχων γεφυρών όπως φαίνεται. Το διένυδρο είναι επίσης τριών συντεταγμένων, με ένα νερό συντονισμένο στον κασσίτερο και ένα δεύτερο συντονισμένο νερό με το πρώτο. Το κύριο μέρος του μορίου στοιβάζεται σε διπλά στρώματα στο κρυσταλλικό πλέγμα, με το “δεύτερο” νερό να περικλείεται μεταξύ των στρωμάτων.
Ο χλωριούχο κασσίτερο (II) μπορεί να διαλύεται σε λιγότερο από τη δική του μάζα νερού χωρίς εμφανή αποσύνθεση, αλλά καθώς αραιώνεται το διάλυμα, λαμβάνει χώρα υδρόλυση για να σχηματίσει ένα αδιάλυτο βασικό άλας:
SnCl2 (υδ) + Η2Ο (1) ñ Sn (ΟΗ) 01 (+) + ΗΟΙ (υδατ.)
Συνεπώς, εάν πρόκειται να χρησιμοποιηθούν διαυγή διαλύματα χλωριούχου κασσιτέρου (II), πρέπει να διαλυθεί σε υδροχλωρικό οξύ (τυπικά της ίδιας ή μεγαλύτερης γραμμομοριακότητας όπως το χλωριούχο κασσίτερο) για να διατηρηθεί η ισορροπία προς την αριστερή πλευρά (με χρήση του Le Chatelier’s αρχή). Τα διαλύματα SnCl2 είναι επίσης ασταθή προς την οξείδωση από τον αέρα:
6 SnCl2 (aq) + 02 (g) + 2 Η2Ο (1) – 2 SnCl4 (aq)
Αυτό μπορεί να αποτραπεί με την αποθήκευση του διαλύματος πάνω σε σβώλους από μέταλλο κασσιτέρου.
Υπάρχουν πολλές τέτοιες περιπτώσεις όπου το χλωριούχο κασσίτερο (II) δρα ως αναγωγικό μέσο, μειώνοντας τα άλατα αργύρου και χρυσού στο μέταλλο και τα άλατα σιδήρου (III) στο σίδηρο (II), για παράδειγμα:
SnCl2 (υδατ.) + 2 FeCl3 (aq) – SnCl4 (aq) + 2 FeCl2 (aq)
Μειώνει επίσης τον χαλκό (II) στον χαλκό (Ι).
Ένα διάλυμα χλωριούχου κασσιτέρου (II) που περιέχει λίγο υδροχλωρικό οξύ χρησιμοποιείται για την επίστρωση κασσίτερου χάλυβα, προκειμένου να κατασκευαστούν κονσέρβες κασσίτερου. Χρησιμοποιείται ηλεκτρικό δυναμικό και σχηματίζεται μέταλλο κασσιτέρου στην κάθοδο μέσω ηλεκτρόλυσης.
Διχλωριούχος Κασσίτερος
Ο χλωριούχος κασσίτερος (II) χρησιμοποιείται ως μέσο πρόσφυσης στην βαφή υφασμάτων, επειδή δίνει λαμπρότερες αποχρώσεις με μερικές βαφές, π.χ. κόκκινη βαφή. Αυτό το νεροχύτη έχει επίσης χρησιμοποιηθεί μόνο για να αυξήσει το βάρος του μετάξι.
Τα τελευταία χρόνια, ένας αυξανόμενος αριθμός μάρκας οδοντόκρεμας προσθέτει χλωριούχος κασσίτερος (II) ως προστασία έναντι της διάβρωσης του σμάλτου στη φόρμουλά του, π.χ. σολ. Oral-B ή Elmex.
Χρησιμοποιείται ως καταλύτης στην παραγωγή του πλαστικού πολυγαλακτικού οξέος (PLA).
Επίσης, βρίσκει χρήση σαν καταλύτη μεταξύ ακετόνης και υπεροξειδίου του υδρογόνου για να σχηματίσει την τετραμερή μορφή υπεροξειδίου ακετόνης.
Το χλωριούχο κασσίτερο (II) βρίσκει ευρεία χρήση ως αναγωγικό παράγοντα. Αυτό φαίνεται στη χρήση του για τους ασημένιους καθρέφτες, όπου εναλλάσσεται αργύλιο στο γυαλί:
Sn2 + (aq) + 2Ag + – Sn4 + (aq) + 2 Ag (s)
Μία σχετική μείωση χρησιμοποιήθηκε παραδοσιακά ως αναλυτική δοκιμή για Hg2 + (aq). Για παράδειγμα, αν προστεθεί στάγδην SnCl2 σε ένα διάλυμα χλωριούχου υδραργύρου (II), σχηματίζεται πρώτα ένα λευκό ίζημα χλωριούχου υδραργύρου (Ι) καθώς προστίθεται περισσότερο SnCl2, αυτό γίνεται μαύρο καθώς σχηματίζεται μεταλλικός υδράργυρος. Το χλωριούχο κασσίτερο μπορεί να χρησιμοποιηθεί για να δοκιμαστεί η παρουσία ενώσεων χρυσού. Το SnCl2 μετατρέπεται σε φωτεινό πορφυρό παρουσία χρυσού (βλ. Purple of Cassius).
Όταν ο υδράργυρος αναλύεται με τη χρήση φασματοσκοπίας ατομικής απορρόφησης, πρέπει να χρησιμοποιηθεί μέθοδος ψυχρού ατμού και τυπικά χρησιμοποιείται χλωριούχος κασσίτερος (II) ως αναγωγικό.
Στην οργανική χημεία, το SnCl2 χρησιμοποιείται κυρίως στη μείωση του Stephen, με αποτέλεσμα να μειώνεται ένα νιτρίλιο (μέσω ενός άλατος ιμιδοϋλοχλωριδίου) σε μια ιμίνη που υδρολύεται εύκολα σε μια αλδεΰδη.
Η αντίδραση συνήθως λειτουργεί καλύτερα με αρωματικά νιτρίλια Aryl-CN. Μια σχετική αντίδραση (που ονομάζεται μέθοδος Sonn-Müller) ξεκινά με ένα αμίδιο, το οποίο επεξεργάζεται με PCl5 για να σχηματίσει το άλας ιμιδοϋλοχλωριδίου.


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones



