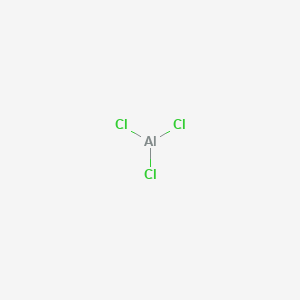
Χλωριούχο Αργίλιο άνυδρο 250g
Το χλωριούχο αργίλιο είναι ανόργανη χημική ένωση με χημικό τύπο AlCl3. Είναι η κύρια χημική ένωση των στοιχείων Αργίλιο (αλουμίνιο) και χλώριο. Είναι λευκό κρυσταλλικό στερεό, αλλά τα δείγματά του έχουν συχνά κίτρινο χρώμα επειδή περιέχουν ίχνη τριχλωριούχου σιδήρου. Το χλωριούχο αργίλιο τήκεται και βράζει σε σχετικώς χαμηλές θερμοκρασίες. Παράγεται και καταναλώνεται από τον άνθρωπο κυρίως κατά τη διαδικασία παραγωγής αλουμινίου, αλλά μεγάλες ποσότητες χρησιμοποιούνται και σε άλλες δραστηριότητες της χημικής βιομηχανίας. Το AlCl3 αναφέρεται συχνά ως οξύ κατά Lewis. Αποτελεί παράδειγμα ανόργανης ενώσεως που «πυρολύεται» σε μέτρια θερμοκρασία, μεταβαλλόμενο αντιστρεπτά από διμερές σε μονομερές.
Φυσικοχημικές Ιδιότητες
Μοριακός τύπος: AlCl3
Μοριακό βάρος: 133.341 g/mol (anhydrous)
Σημείο ζέσης: αποσυντίθεται
Σημείο τήξης: 192,4 °C
Πυκνότητα: 2,48 gr/cm3
Διαλυτότητα στο νερό: 43,9 gr/100 ml (0 °C)
45,8 gr/100 ml (20 °C)
49 gr/100 ml (100 °C)
Εμφάνιση: λευκό ή υποκίτρινο κρυσταλλικό στερεό
Χημική Δομή
Ασφάλεια και αποθήκευση
Διαβρωτικό
Διατηρείται σε θερμοκρασία δωματίου.
Αναλυτική περιγραφή
Το AlCl3 λαμβάνει τρεις διαφορετικές δομές ανάλογα με τη θερμοκρασία και την κατάσταση (στερεό ή υγρό). Το στερεό χλωριούχο αργίλιο αποτελείται από φυλλοειδείς πυκνές κυβικές διαστρωματώσεις. Σε αυτή τη δομή τα άτομα Al επιδεικνύουν οκταεδρική μοριακή γεωμετρία. Σε τήγμα η ένωση έχει τη μορφή διμερούς: Al2Cl6. Αυτή η μεταβολή στη δομή σχετίζεται με τη μικρότερη πυκνότητα του υγρού (1,78 gr/cm3 έναντι 2,48 του στερεού). Τα διμερή Al2Cl6 υπάρχουν και ως ατμοί. Σε υψηλότερες θερμοκρασίες, τα διμερή διίστανται σε τριγωνικά επίπεδα μόρια AlCl3, που είναι δομικώς ανάλογα με αυτά του BF3. Το υγρό χλωριούχο αργίλιο δεν είναι τόσο καλός αγωγός του ηλεκτρισμού όσο άλλα αλογονίδια, όπως το χλωριούχο νάτριο.
Το AlCl3 βρίσκει εφαρμογή στη χημική βιομηχανία ως καταλύτης για αντιδράσεις Friedel-Crafts, τόσο ακυλιώσεως, όσο και αλκυλιώσεως. Σημαντικά προϊόντα που προκύπτουν από αυτές είναι κάποια απορρυπαντικά και αιθυλοβενζόλιο. Χρησιμεύει επίσης σε αντιδράσεις πολυμερισμού και ισομερισμού υδρογονανθράκων.
Αντίδραση Friedel-Crafts με χλωριούχο αργίλιο είναι και η σύνθεση ανθρακινόνης (για τη βιομηχανία χρωστικών) από βενζόλιο και φωσγένιο. Οι αντιδράσεις αλκυλιώσεως χρησιμοποιούνται ευρύτερα από τις αντιδράσεις ακυλιώσεως, παρότι είναι απαιτητικότερες από τεχνικής πλευράς επειδή είναι βραδύτερες. Για αμφότερες τις κατηγορίες αντιδράσεων, το χλωριούχο αργίλιο, τα υπόλοιπα υλικά και ο εξοπλισμός πρέπει να είναι ξηρά, αν και ίχνη υγρασίας είναι απαραίτητα για την αντίδραση. Γενικό πρόβλημα με την αντίδραση Friedel-Crafts είναι ότι ο καταλύτης χλωριούχου αργιλίου απαιτείται κάποιες φορές σε ακριβείς στοιχειομετρικές ποσότητες, επειδή συμπλέκεται ισχυρά με τα προϊόντα. Αυτή η ιδιότητα δημιουργεί κάποτε μεγάλες ποσότητες διαβρωτικών παραπροϊόντων. Για αυτούς και παρόμοιους λόγους, έχουν αναζητηθεί φιλικότεροι προς το περιβάλλον καταλύτες και η χρήση του χλωριούχου αργιλίου σε μερικές εφαρμογές αντικαθίσταται από ζεόλιθους.
Το AlCl3 μπορεί να χρησιμοποιηθεί επίσης για την εισαγωγή αλδεϋδικών ομάδων σε αρωματικούς δακτυλίους, π.χ. με την αντίδράση Gattermann-Koch, που χρησιμοποιεί μονοξείδιο του άνθρακα, υδροχλώριο και μονοχλωριούχο χαλκό ως συγκαταλύτη.
Υπάρχουν πολλές και ποικίλες άλλες εφαρμογές του χλωριούχου αργιλίου στην οργανική χημεία. Για παράδειγμα, μπορεί να καταλύσει την «αντίδραση Alder-ene», όπως είναι η προσθήκη βουτενόνης σε καρβόνη:
Το AlCl3 χρησιμοποιείται επίσης ευρύτατα για αντιδράσεις πολυμερισμού και ισομερισμού υδρογονανθράκων, με σημαντικά παραδείγματα την παραγωγή αιθυλοβενζολίου, από το οποίο παράγεται στυρένιο και από αυτό το πολυστυρένιο, καθώς και την παραγωγή δωδεκυλοβενζολίου, το οποίο χρησιμεύει στην παραγωγή απορρυπαντικών.
Το χλωριούχο αργίλιο μαζί με αλουμίνιο και με την παρουσία ενός αρενίου μπορεί να χρησιμοποιηθεί για τη σύνθεση διαρενικών μεταλλικών συμπλόκων, π.χ. του διβενζολιοχρωμίου, από κάποια αλογονίδια μετάλλων («σύνθεση Fischer-Hafner»).


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones