Τρισουλφίδιο του Αντιμονίου 500g 98%
Τρισουλφίδιο του Αντιμονίου 500g 98%
CAS Number: 1345-04-6
Το τριθειώδες αντιμόνιο (Sb2S3) βρίσκεται στη φύση ως το κρυσταλλικό ορυκτό στιβνίτης και το άμορφο κόκκινο ορυκτό (στην πραγματικότητα ένα ορυκτοειδές) μεταστιβνίτης. Κατασκευάζεται για χρήση σε αγώνες ασφαλείας, στρατιωτικά πυρομαχικά, εκρηκτικά και πυροτεχνήματα. Χρησιμοποιείται επίσης στην παραγωγή γυαλιού σε χρώμα ρουμπινί και σε πλαστικά ως επιβραδυντικό φλόγας. Ιστορικά η μορφή στιβνίτη χρησιμοποιήθηκε ως γκρι χρωστική ουσία σε πίνακες ζωγραφικής που δημιουργήθηκαν τον 16ο αιώνα. Το 1817, ο χημικός βαφών και υφασμάτων, John Mercer, ανακάλυψε τη μη στοιχειομετρική ένωση Antimony Orange (κατά προσέγγιση τύπος Sb2S3·Sb2O3), την πρώτη καλή πορτοκαλί χρωστική ουσία διαθέσιμη για εκτύπωση βαμβακερών υφασμάτων.
Το τριθειώδες αντιμόνιο χρησιμοποιήθηκε επίσης ως ευαίσθητος στην εικόνα φωτοαγωγός σε σωλήνες κάμερας vidicon. Είναι ένας ημιαγωγός με άμεσο διάκενο ζώνης 1,8–2,5 eV. Με κατάλληλο ντόπινγκ, μπορούν να παραχθούν υλικά τύπου p και n.
Φυσικοχημικές Ιδιότητες
| Names | |
|---|---|
| IUPAC names Antimony(III) sulfide Diantimony trisulfide | |
Other names
|
| Identifiers | |
|---|---|
3D model (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.014.285 |
PubChem CID | |
| UNII | |
CompTox Dashboard (EPA) | |
| Properties | |
|---|---|
| Sb2S3 | |
| Molar mass | 339.70 g·mol−1 |
| Appearance | Grey or black orthorhombic crystals (stibnite) |
| Density | 4.562g cm−3 (stibnite) |
| Melting point | 550 °C (1,022 °F; 823 K) (stibnite) |
| Boiling point | 1,150 °C (2,100 °F; 1,420 K) |
| 0.00017 g/(100 mL) (18 °C) | |
| −86.0·10−6 cm3/mol | |
Refractive index (nD) | 4.046 |
| Thermochemistry | |
|---|---|
Heat capacity (C) | 123.32 J/(mol·K) |
Std enthalpy of formation (ΔfH⦵298) | −157.8 kJ/mol |
Χημική Δομή
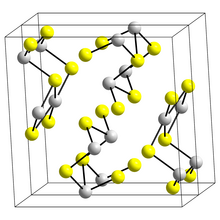
Η δομή της μαύρης βελονοειδούς μορφής του Sb2S3, του στιβνίτη, αποτελείται από συνδεδεμένες κορδέλες στις οποίες τα άτομα αντιμονίου βρίσκονται σε δύο διαφορετικά περιβάλλοντα συντονισμού, το τριγωνικό πυραμιδικό και το τετράγωνο πυραμιδικό. Παρόμοιες κορδέλες εμφανίζονται στα Bi2S3 και Sb2Se3. Η ερυθρή μορφή, ο μεταστιβνίτης, είναι άμορφη. Πρόσφατη εργασία υποδηλώνει ότι υπάρχει ένας αριθμός στενά σχετιζόμενων δομών στιβνίτη που εξαρτώνται από τη θερμοκρασία που έχουν ονομαστεί στιβνίτης (Ι) η μορφή υψηλής θερμοκρασίας, που προσδιορίστηκε προηγουμένως, στιβνίτης (II) και στιβνίτης (III). Άλλο έγγραφο δείχνει ότι τα πραγματικά πολύεδρα συντονισμού του αντιμονίου είναι στην πραγματικότητα SbS7, με (3+4) συντονισμό στη θέση Μ1 και (5+2) στη θέση Μ2. Αυτοί οι συντονισμοί εξετάζουν την παρουσία δευτερευόντων δεσμών. Μερικοί από τους δευτερογενείς δεσμούς προσδίδουν συνοχή και συνδέονται με τη συσκευασία.
Ασφάλεια και αποθήκευση

Προκαλεί ερεθισμό στα μάτια και στο δέρμα.
Περιβαλλοντικός κίνδυνος.
Διατηρείται σε θερμοκρασία δωματίου.
Παρασκευές
Το Sb2S3 μπορεί να παρασκευαστεί από τα στοιχεία σε θερμοκρασία 500–900 °C:
2 Sb + 3 S → Sb2S3
Το Sb2S3 κατακρημνίζεται όταν το H2S διέρχεται μέσω ενός οξινισμένου διαλύματος Sb(III). Αυτή η αντίδραση έχει χρησιμοποιηθεί ως βαρυμετρική μέθοδος για τον προσδιορισμό του αντιμονίου, διοχετεύοντας φυσαλίδες H2S μέσω ενός διαλύματος ένωσης Sb(III) σε θερμό HCl εναποθέτει μια πορτοκαλί μορφή Sb2S3 που γίνεται μαύρο υπό τις συνθήκες αντίδρασης.
Το Sb2S3 οξειδώνεται εύκολα, αντιδρώντας έντονα με οξειδωτικά μέσα. Καίγεται στον αέρα με μια μπλε φλόγα. Αντιδρά με πυράκτωση με χλωριούχα κάδμιο, μαγνήσιο και ψευδάργυρο. Μείγματα Sb2S3 και χλωρικών αλάτων μπορεί να εκραγούν.
Στην εξόρυξη αντιμονίου από μεταλλεύματα αντιμονίου χρησιμοποιείται η διαδικασία αλκαλικού σουλφιδίου όπου το Sb2S3 αντιδρά για να σχηματίσει θειοαντιμονικά (III) άλατα (ονομάζονται επίσης θειοαντιμονίτη):
3 Na2S + Sb2S3 → 2 Na3SbS3
Ένας αριθμός αλάτων που περιέχουν διαφορετικά θειοαντιμονικά (III) ιόντα μπορεί να παρασκευαστεί από το Sb2S3. Αυτά περιλαμβάνουν:
[SbS3]3−, [SbS2]−, [Sb2S5]4−, [Sb4S9]6−, [Sb4S7]2− και [Sb8S17]10−
Το άλας του Schlippe, Na3SbS4·9H2O, ένα θειοαντιμονικό (V) άλας σχηματίζεται όταν το Sb2S3 βράζει με θείο και υδροξείδιο του νατρίου. Η αντίδραση μπορεί να αναπαρασταθεί ως:
Sb2S3 + 3 S2− + 2 S → 2 [SbS4]3−


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones




