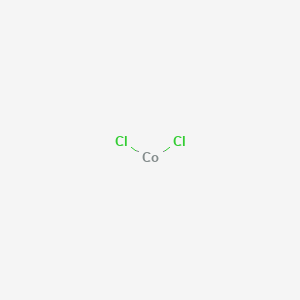
Χλωριούχο Κοβάλτιο 100g
Το Χλωριούχο κοβάλτιο (ΙΙ) είναι ανόργανη ένωση του χλωρίου και του κοβαλτίου, με τύπο CoCl2. Συχνά απαντάται με την εξαένυδρη μορφή του CoCl2·6H2O, που είναι μία από τις πιο χρησιμοποιημένες ενώσεις κοβαλτίου στο εργαστήριο. Η εξαένυδρη έχει βαθύ βιολετί χρώμα, ενώ η άνυδρη μορφή CoCl2 έχει χρώμα γαλάζιο. Ένα μείγμα τους θα ήταν μοβ.
Η ένωση χρησιμοποιείται συχνά για να αποδείξει την έκλυση υδρατμών κατά τη διάρκεια κάποιας χημικής αντίδρασης αφού όταν έρχεται σε επαφή με υγρασία αλλάζει χρώμα από γαλάζιο σε βιολετί. Χρησιμοποιείται, λόγω των ιδιοτήτων του ως δείκτης σε Τζέλ Σιλικόνης.
Φυσικοχημικές Ιδιότητες
Μοριακός τύπος: CoCl2 x 6H2O
Μοριακό βάρος: 237.93 g/mol (hexahydrate)
Σημείο ζέσης: 1049 °C
Σημείο τήξης: 86 °C (hexahydrate)
Πυκνότητα: 1.924 g/cm3 (hexahydrate)
Διαλυτότητα στο νερό:
43.6 g/100 mL (0 °C)45 g/100 mL (7 °C)
52.9 g/100 mL (20 °C)
105 g/100 mL (96 °C)
Εμφάνιση: κόκκινοι/ροζ κρύσταλλοι
Χημική Δομή
Ασφάλεια και αποθήκευση



Προκαλεί ερεθισμό στα μάτια και στο δέρμα Διαβρωτικό Επικίνδυνο για την υγεία Επικίνδυνο για το περιβάλλον
Το κοβάλτιο είναι απαραίτητο για τις περισσότερες υψηλότερες μορφές ζωής, αλλά περισσότερα από μερικά χιλιοστόγραμμα ημερησίως είναι επιβλαβή. Παρόλο που οι δηλητηριάσεις έχουν σπάνια προκύψει από ενώσεις κοβαλτίου, η χρόνια πρόσληψη τους έχει προκαλέσει σοβαρά προβλήματα υγείας σε δόσεις πολύ μικρότερες από τη θανατηφόρα δόση. Το 1966, η προσθήκη ενώσεων κοβαλτίου για τη σταθεροποίηση του αφρού μπύρας στον Καναδά οδήγησε σε μια ιδιόμορφη μορφή καρδιομυοπάθειας που προκαλείται από την τοξίνη, η οποία έγινε γνωστή ως καρδιομυοπάθεια του ποτού του μπύρα.
Επιπλέον, υπάρχει υποψία ότι το χλωριούχο κοβάλτιο (II) προκαλεί καρκίνο (δηλ. Πιθανώς καρκινογόνο, ομάδα IARC 2Β) σύμφωνα με τις μονογραφίες του Διεθνούς Οργανισμού Έρευνας για τον Καρκίνο (IARC).
Το 2005-06, το χλωριούχο κοβάλτιο ήταν το όγδοο-πιο διαδεδομένο αλλεργιογόνο στις δοκιμές έμπλαστρου (8,4%).
Διατηρείται σε θερμοκρασία δωματίου.
Αναλυτική περιγραφή
Στο εργαστήριο, το χλωριούχο κοβάλτιο (II) χρησιμεύει ως ένας κοινός πρόδρομος για άλλες ενώσεις κοβαλτίου. Γενικά, τα υδατικά διαλύματα του άλατος συμπεριφέρονται όπως και άλλα άλατα κοβαλτίου (II), δεδομένου ότι αυτά τα διαλύματα αποτελούνται από ιόντα [Co (Η2Ο) 6] 2+ ανεξάρτητα από το ανιόν. Για παράδειγμα, τέτοια διαλύματα δίδουν ένα ίζημα σουλφιδίου κοβαλτίου CoS με κατεργασία με υδρόθειο H2S.


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones