Χλωρικό Κάλιο 250g
Χλωρικό Κάλιο 250g
Το χλωρικό κάλιο είναι μια ένωση που περιέχει κάλιο, χλώριο και οξυγόνο, με τον μοριακό τύπο KClO3. Στην καθαρή του μορφή, είναι μια λευκή κρυσταλλική ουσία. Είναι το πιο κοινό χλωρικό άλας στη βιομηχανική χρήση. Χρησιμοποιείται,
ως οξειδωτικό παράγοντα,
για την παρασκευή οξυγόνου,
ως απολυμαντικό,
σε αγώνες ασφαλείας,
σε εκρηκτικά και πυροτεχνήματα,
στην καλλιέργεια, αναγκάζοντας το στάδιο άνθησης του δέντρου longan, προκαλώντας την παραγωγή φρούτων σε θερμότερα κλίματα.
Φυσικοχημικές Ιδιότητες
Μοριακός τύπος: KClO3
Μοριακό βάρος: 122.55 g mol−1
Σημείο ζέσης: 400 °C
Σημείο τήξης: 356 °C
Πυκνότητα: 2.32 g/cm3
Διαλυτότητα στο νερό: 3.13 g/100 mL (0 °C)
4.46 g/100 mL (10 °C)
8.15 g/100 mL (25 °C)
13.21 g/100 mL (40 °C)
53.51 g/100 mL (100 °C)
183 g/100 g (190 °C)
2930 g/100 g (330 °C)
Εμφάνιση: λευκή κρυσταλλική μορφή (σαν τη κρυσταλλική ζάχαρη)
Χημική Δομή Χλωρικό Κάλιο 250g
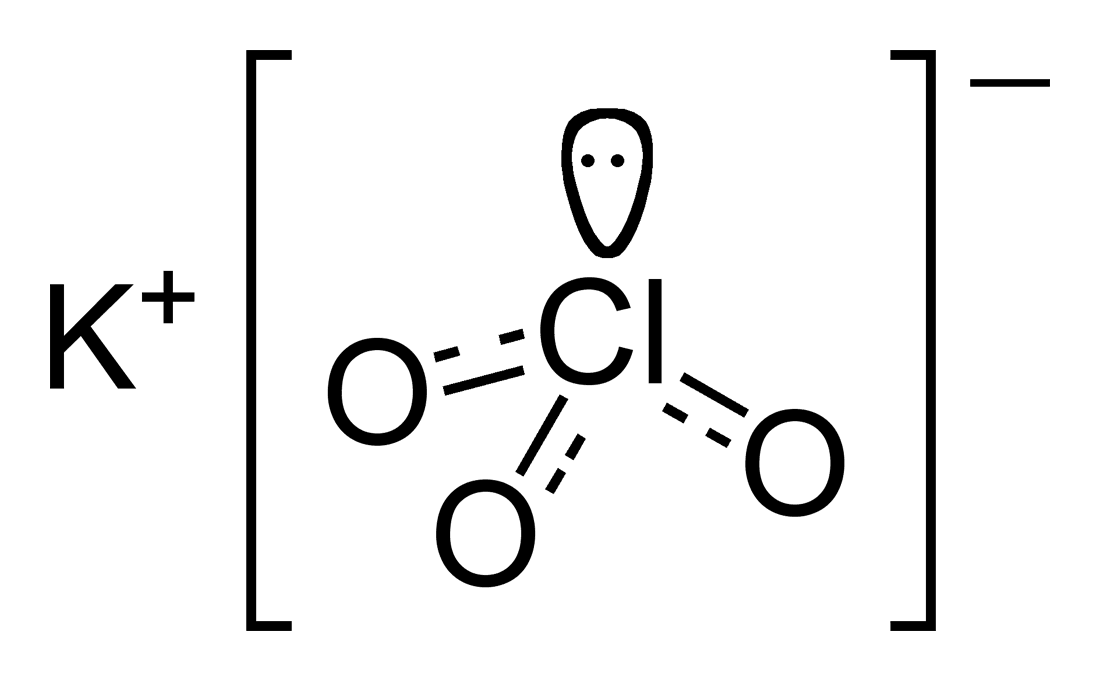
Ασφάλεια και Αποθήκευση


Οξειδωτικό Επικίνδυνο για το περιβάλλον Προκαλεί ερεθισμό στα μάτια και στο δέρμα
Διατηρείται σε θερμοκρασία δωματίου.
Αναλυτική περιγραφή
Το χλωρικό άλας του καλίου ήταν ένα βασικό συστατικό στα πρώιμα πτερύγια κρούσης πυροβόλων όπλων (πριμοδότες). Συνεχίζει σε εκείνη την εφαρμογή, όπου δεν αντικαθίσταται από υπερχλωρικό κάλιο.
Τα προωθητικά με βάση το χλωράνιο είναι πιο αποτελεσματικά από την παραδοσιακή πυρίτιδα και είναι λιγότερο επιρρεπή σε βλάβες από το νερό. Ωστόσο, μπορεί να είναι εξαιρετικά ασταθείς παρουσία θείου ή φωσφόρου και είναι πολύ πιο ακριβά. Χλωρικά προωθητικά πρέπει να χρησιμοποιούνται μόνο σε εξοπλισμό που έχει σχεδιαστεί για αυτούς. η μη τήρηση αυτής της προφύλαξης αποτελεί κοινή πηγή ατυχημάτων. Το χλωρικό κάλιο, συχνά σε συνδυασμό με το fulminate του αργύρου, χρησιμοποιείται σε κατασκευαστές θορύβου που είναι γνωστοί ως “crackers”, “snappers”, “pop-it” ή “bang-snaps”, ένας δημοφιλής τύπος πυροτεχνίας καινοτομίας.
Μια άλλη εφαρμογή χλωρικού καλίου είναι ως οξειδωτικό σε σύνθεση καπνού όπως αυτή που χρησιμοποιείται σε χειροβομβίδες καπνού. Από το 2005, ένα φυσίγγιο με χλωρικό κάλιο αναμεμειγμένο με λακτόζη και κολοφώνιο χρησιμοποιείται για τη δημιουργία του λευκού καπνού που σηματοδοτεί την εκλογή νέου παπά από παπικό σύμβολο.
Το χλωρικό κάλιο χρησιμοποιείται συχνά σε εργαστήρια γυμνασίου και κολλεγίων για την παραγωγή αερίου οξυγόνου. Είναι μια πολύ φθηνότερη πηγή από μια δεξαμενή οξυγόνου υπό πίεση ή κρυογονικό. Το χλωρικό κάλιο αποσυντίθεται εύκολα αν θερμαίνεται ενώ βρίσκεται σε επαφή με καταλύτη, τυπικά διοξείδιο μαγγανίου (IV) (MnO2). Έτσι, μπορεί απλά να τοποθετηθεί σε δοκιμαστικό σωλήνα και να θερμανθεί πάνω από έναν καυστήρα. Αν ο δοκιμαστικός σωλήνας είναι εφοδιασμένος με πώμα και εύκαμπτο σωλήνα, μπορεί να αφαιρεθεί θερμό οξυγόνο. Η αντίδραση έχει ως εξής:
2 KCI03 (s) → 3O2 (g) + 2 KCl (s)
Η θέρμανση του απουσία ενός καταλύτη το μετατρέπει σε υπερχλωρικό κάλιο:
4 KCI03 → 3 KCI04 + KCl
Με περαιτέρω θέρμανση, το υπερχλωρικό κάλιο αποσυντίθεται σε χλωριούχο κάλιο και οξυγόνο:
KClO4 → KCl + 202
Χρήσεις
Το χλωρικό κάλιο χρησιμοποιείται σε χημικές γεννήτριες οξυγόνου (που ονομάζονται επίσης κεριά χλωρικού ή κεριά οξυγόνου), που χρησιμοποιούνται ως συστήματα παροχής οξυγόνου π.χ. αεροσκάφη, διαστημικούς σταθμούς και υποβρύχια και έχει ευθύνη για τουλάχιστον ένα αεροπορικό δυστύχημα. Μια πυρκαγιά στον διαστημικό σταθμό Mir εντοπίστηκε επίσης σε αυτή την ουσία. Η αποσύνθεση του χλωρικού καλίου χρησιμοποιήθηκε επίσης για την παροχή της παροχής οξυγόνου για τα φώτα του φως.
Το χλωρικό κάλιο χρησιμοποιείται επίσης ως παρασιτοκτόνο. Στη Φινλανδία πωλήθηκε με την εμπορική ονομασία Fegabit.
Το χλωρικό κάλιο μπορεί να αντιδράσει με θειικό οξύ για να σχηματίσει ένα εξαιρετικά αντιδραστικό διάλυμα χλωρικού οξέος και θειικού καλίου:
2 KCI03 + H2S04 → 2 HCI03 + K2S04
Η έτσι παραχθείσα λύση είναι επαρκώς αντιδραστική ώστε να αναφλέγεται αυθόρμητα εάν υπάρχει καύσιμο υλικό (ζάχαρη, χαρτί, κλπ.).
Στα σχολεία, το λιωμένο κλωνικό κάλιο χρησιμοποιείται στα δραματικά μωρά ζελέ ουρλιάζοντας, το Gummy bear, το Haribo, και η επίδειξη καραμελών Trolli όπου η καραμέλα πέφτει στο τηγμένο αλάτι.
Στα χημικά εργαστήρια χρησιμοποιείται για την οξείδωση του HCl και την απελευθέρωση μικρών ποσοτήτων αερίου χλωρίου.


 Φυσική
Φυσική Χημεία
Χημεία Βιολογία
Βιολογία Μαθηματικά
Μαθηματικά Περιβάλλον – Οικολογία
Περιβάλλον – Οικολογία Επιστήμες της Γης
Επιστήμες της Γης Τεχνολογία
Τεχνολογία Προσχολικά – Σχολικά
Προσχολικά – Σχολικά Ειδική Αγωγή
Ειδική Αγωγή Σχολικός Εξοπλισμός
Σχολικός Εξοπλισμός Τέχνες & Αθλητισμός
Τέχνες & Αθλητισμός Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική
Χειροτεχνία – Χαρτικά – Γραφική ύλη – Ζωγραφική Ψηφιακή Τάξη
Ψηφιακή Τάξη Απαγωγοί
Απαγωγοί Ντουλάπες Φύλαξης
Ντουλάπες Φύλαξης Ψυγεία Καταψύκτες
Ψυγεία Καταψύκτες Εργαστηριακές Συσκευές
Εργαστηριακές Συσκευές Πάγιος Εργαστηριακός Εξοπλισμός
Πάγιος Εργαστηριακός Εξοπλισμός Χημικά Αντιδραστήρια
Χημικά Αντιδραστήρια Ιατρικός – Νοσοκομειακός εξοπλισμός
Ιατρικός – Νοσοκομειακός εξοπλισμός Μικροσκόπια – Στερεοσκόπια
Μικροσκόπια – Στερεοσκόπια USB Αισθητήρες & MBL Αισθητήρες
USB Αισθητήρες & MBL Αισθητήρες STEM EDUCATION
STEM EDUCATION Science School
Science School Εργαστήρια Δεξιοτήτων
Εργαστήρια Δεξιοτήτων Φυσικών Επιστημών Προσχολικής
Φυσικών Επιστημών Προσχολικής Φυσικών Επιστημών Ε & ΣΤ Δημοτικού
Φυσικών Επιστημών Ε & ΣΤ Δημοτικού Πακέτα Ασκήσεων Δευτεροβάθμιας
Πακέτα Ασκήσεων Δευτεροβάθμιας Η Φυσική με Πειράματα – Γυμνασίου
Η Φυσική με Πειράματα – Γυμνασίου Εκπαιδευτικά Σετ
Εκπαιδευτικά Σετ Εκπαιδευτικά Πακέτα Μικροκλίμακας
Εκπαιδευτικά Πακέτα Μικροκλίμακας BeeBot
BeeBot Botzees
Botzees EDISON
EDISON Gigo
Gigo Botley
Botley Spike
Spike Εξοπλισμός Υπουργείου
Εξοπλισμός Υπουργείου Εξοπλισμός Σχολείων 1821
Εξοπλισμός Σχολείων 1821 Arduino
Arduino MicroBit
MicroBit Raspberry Pi
Raspberry Pi Elecfreaks
Elecfreaks Keyestudio
Keyestudio Fischertechnik
Fischertechnik Grove Πλατφόρμα Ανάπτυξης
Grove Πλατφόρμα Ανάπτυξης DFRobot
DFRobot WaveShare
WaveShare Αισθητήρες
Αισθητήρες Μοτέρ και Ενεργοποιητές
Μοτέρ και Ενεργοποιητές 3D Printing
3D Printing Laser Engraver
Laser Engraver Προσφορές
Προσφορές Drones
Drones


